Le Tecniche di Evoluzione Assistita (TEA) come il gene editing rappresentano un passo importante in questa direzione e sono attualmente allo studio applicazioni in viticoltura così come su altre specie. Si basano sulla tecnologia Crispr/Cas (Clustered regularly interspaced short palindromic repeats/Crispr-associated), scoperta da Jennifer Doudna ed Emanuelle Charpentier (Jinek et al., 2012) e valsa loro il premio Nobel per la chimica nel 2020. In pratica gli enzimi di tipo Cas (come il Cas9) sono forbici molecolari che tagliano il DNA della cellula in un punto specifico. Una forbice Cas9 si accoppia a una molecola di RNA chiamata guida, che la conduce a un punto specifico del genoma dove c’è perfetta complementarietà di sequenza tra l’RNA e il DNA.
Se l’appaiamento tra l’RNA guida e il genoma è perfetto allora Cas9 taglia il DNA obbligando la cellula a riparare tale rottura, con un processo soggetto a errore. Spesso, infatti, il sistema di aggiustamento del DNA causa l’introduzione di una piccola mutazione come la scomparsa o l’aggiunta di una «lettera» alla sequenza di DNA. Tale mutazione è detta puntiforme, e mima perfettamente quello che capita in natura (per questo motivo sono state chiamate Tecniche di Evoluzione Assistita), in un processo sempre in corso e che tramite selezione dei mutanti ha permesso la domesticazione di tutte le specie vegetali che coltiviamo.
Sequenze bersaglio: geni di suscettibilità
Molto spesso mutazioni nella sequenza codificante di un gene come piccole inserzioni o delezioni di paia di basi portano all’alterazione del registro di lettura del gene stesso da parte del ribosoma, per cui non viene prodotta una proteina funzionale: si parla in questo caso di mutazione a perdita di funzione o più spesso di inattivazione («knockout») del gene. I bersagli ideali per dei knockout mirati sono quindi geni che, se attivi nella pianta, consentono e/o facilitano l’infezione da parte del fungo patogeno: tali geni sono definiti geni S, o geni di suscettibilità.
Editing nella cellula
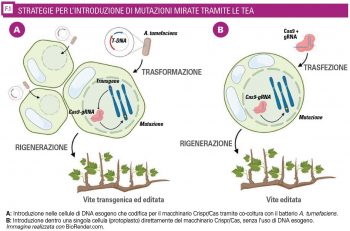
Per introdurre le mutazioni mirate nei geni S è necessario fornire alle cellule della pianta un complesso Crispr/Cas funzionale, composto dalla proteina Cas9 e dall’RNA guida. Questo si ottiene tradizionalmente in vite tramite l’inserzione nella pianta dei geni che codificano per il complesso.
Questo approccio classico comporta degli svantaggi: innanzitutto la pianta prodotta è transgenica, e in secondo luogo il transgene che codifica per Crispr/Cas continua a essere presente e attivo nella pianta, rendendo nel tempo non più trascurabile il rischio di avere mutazioni fuori bersaglio.
Esistono solo due modi per rimuovere il DNA esogeno integrato dalla pianta:
- tramite segregazione: questa strategia è stata applicata con successo a specie orticole, ma in vite farebbe cadere il presupposto del mantenimento varietale e clonale;
- tramite excisione molecolare: esistono protocolli già usati in ricerca sulla vite (Dalla Costa et al., 2020) per l’eliminazione del transgene, il processo però è impreciso e non porta all’eliminazione totale del DNA esogeno, e le tracce che rimangono sono sufficienti per mantenere la pianta classificata come transgenica secondo la legge italiana.
Per superare questi problemi è opportuno adottare una strategia che non preveda l’uso di DNA esogeno, ma l’inserimento in pianta direttamente del complesso proteina-RNA, che è in grado di apportare le mutazioni desiderate in maniera transiente.
Tratto dall’articolo pubblicato su Vite&Vino n. 2/2023
Genome editing: a che punto siamo?
di U. Salvagnin, L. Giacomelli, C. Moser
Per leggere l’articolo completo abbonati a Vite&Vino




